Histologie

Microtome à paraffine (Leica LM2245)
Permet de réaliser des coupes fines (4-8 µm) sur des tissus fixés et inclus en paraffine. Ces coupes peuvent ensuite être soumises à des colorations histologiques pour analyser la structure tissulaire et/ou à des immunomarquages (immunohistochimie, immunofluorescence) pour localiser des protéines d’intérêt.

Cryostat (Leica CM1900)
Permet de réaliser des coupes fines à épaisses (20-100 µm) sur des tissus congelés. Lorsque les tissus sont congelés frais (immédiatement après la dissection), les coupes devront être fixées avant de réaliser des colorations histologiques et des immunomarquages. Les tissus peuvent également être fixés avant la congélation ce qui limitera les artéfacts liés à celle-ci, en particulier si les tissus sont immergés préalablement dans un cryoprotectant (Sucrose) avant la congélation.
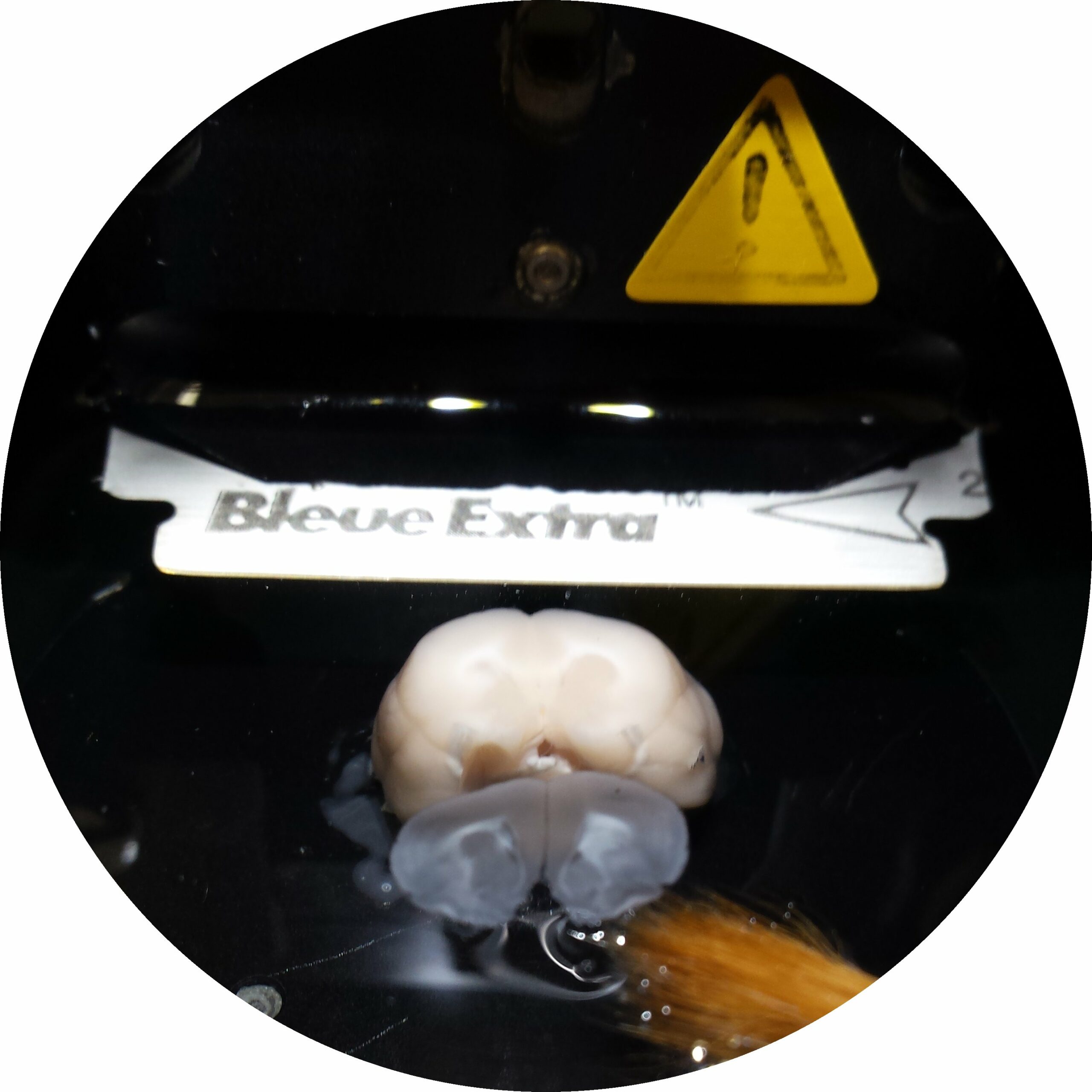
Vibratome (Leica VT1200S)
Permet de réaliser des coupes épaisses (>30 µm) sur des tissus fixés mais non inclus. Après immunomarquage, ces coupes peuvent être observées en microscopie confocale. Cette procédure permet d’éviter les artéfacts liés à l’inclusion en paraffine (altération de l’antigénicité des cibles) et à la congélation (altération de la structure). Elle permet également de réaliser des observations en 3D sur une épaisseur importante.
Microscopie électronique

Cryoplongeur (LEICA EM-GP2)
Permet la congélation ultra-rapide d’un film mince d’échantillons en suspension. Quelques µL d’échantillons sont déposées sur une grille, l’excès est absorbé par un papier filtre puis la grille est plongée dans un bain d’éthane liquide refroidi à -180°C. L’ensemble du processus est automatisé pour une meilleure reproductibilité. Les grilles sont ensuite transférées dans un porte-objet cryogénique et observés en TEM à -170°C (cryo-TEM).

Ultramicrotome (Leica EM UC7)
Permet de réaliser des coupes semifines (250 nm à 1 µm) et ultrafines (80 à 250 nm) sur des échantillons inclus en résine (Epon). Les coupes semi-fines sont ensuite colorées et observées en microscopie optique à fond clair. Les coupes ultrafines peuvent être contrastées si nécessaire (acétate d’uranyle, citrate de plomb) puis observées en microscopie électronique à transmission en mode TEM conventionnel ou STEM/EDX pour l’analyse élémentaire.

Métalliseur (Jeol JFC-1300)
Permet de recouvrir les échantillons non-conducteurs d’une couche métallique (alliage Au/pd) de quelques nanomètres avant observation en microscopie électronique à balayage.

Plasma Cleaner (Harrick Plasma PDC-32G-2)
Permet de soumettre les grilles recouvertes d’un film de carbone (hydrophobe) à un plasma afin de le rendre hydrophile. Selon le gaz utilisé on peut obtenir une surface chargée négativement (air ambiant) ou positivement (pentylamine).
À lire aussi
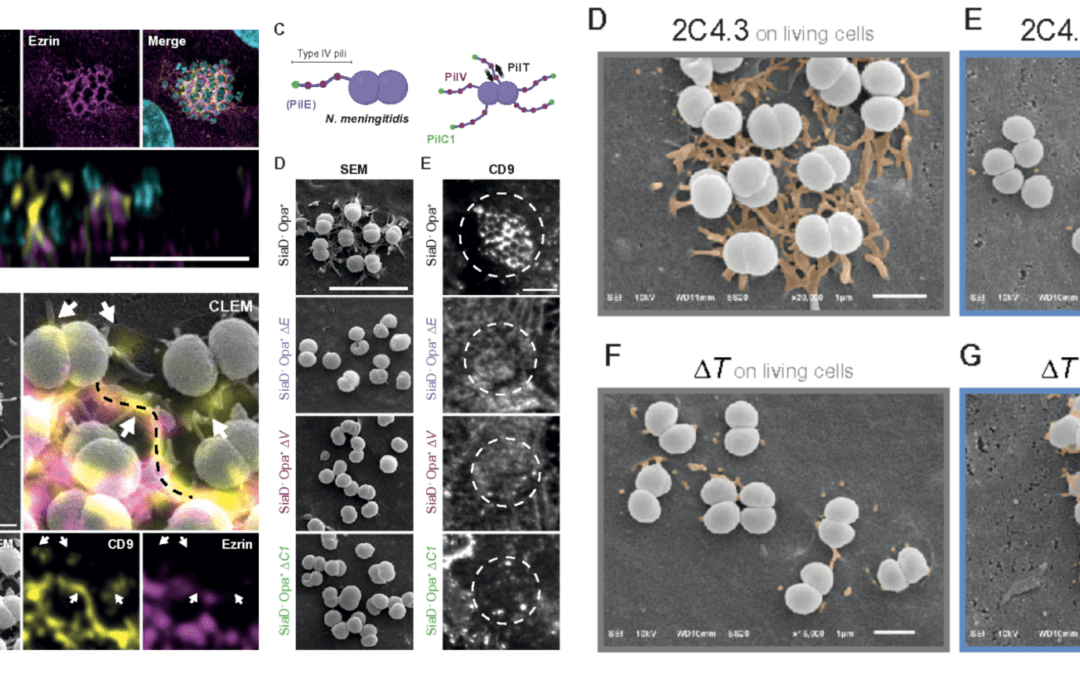
Publié récemment
L’équipe de Mathieu COUREUIL (Institut Necker Enfants Malades, Inserm, CNRS, Université Paris Cité) a découvert un nouveau mécanisme d’interaction entre la bactérie N. meningitidis et la membrane des cellules endothéliales, grâce en particulier à la CLEM.

Publié récemment
L’équipe de Sonja BOLAND et Stéphanie DEVINEAU (Unité Biologie Fonctionnelle et Adaptative, CNRS, UPCité, Paris, France ) a étudié l’effet des nanoplastiques (NP, < 1 µm) sur les cellules épithéliales bronchiques et alvéolaires humaines.
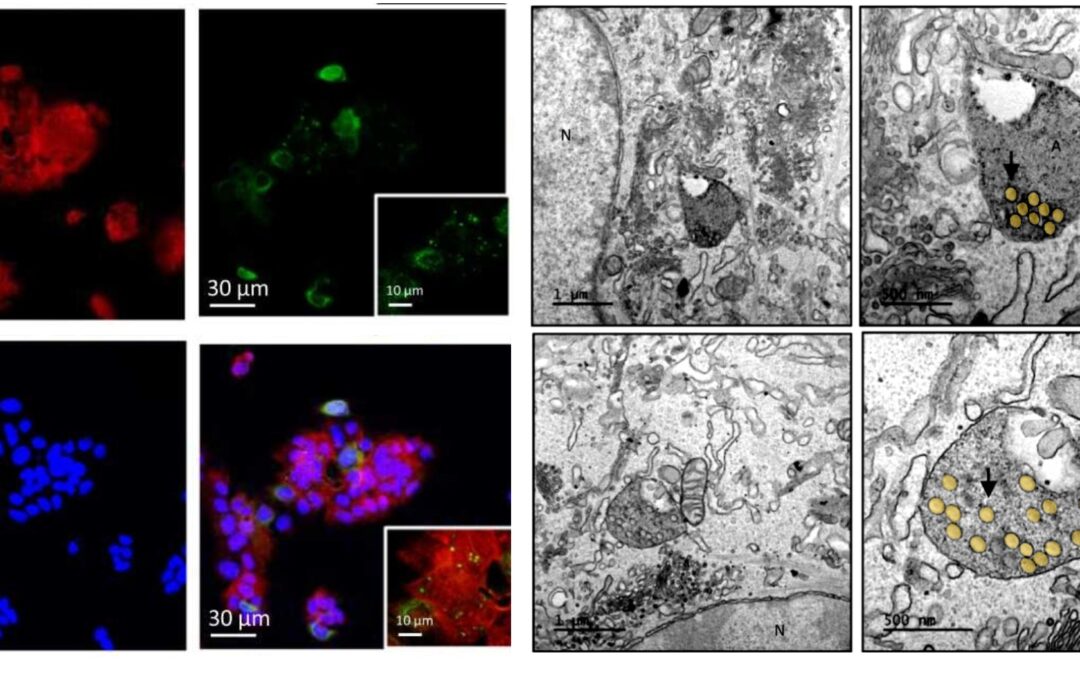
Publié récemment
Le Dr Amal Zerrad-Saadi de l’Université Paris Cité révèle pour la première fois les conséquences d’une exposition aigue à des nanoplastiques sur le placenta humain chez la femme enceinte.
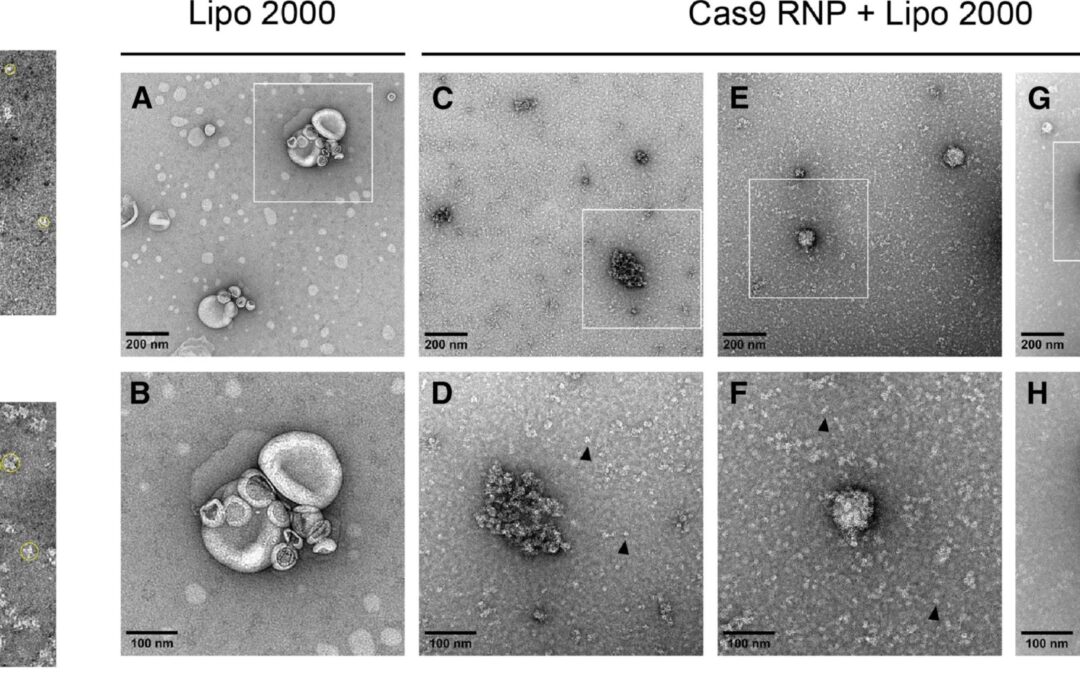
Publié récemment
Le Dr Deniz DALKARA (Institut de la Vision, Inserm UMRS 968, Paris) a utilisé la TEM pour caractériser des complexes cas9-ARN destinés à l’édition génique dans les photorécepteurs de la rétine.
