Les objets dont la taille ne dépasse pas les quelques dizaines de nm (au moins dans une dimension) peuvent être observés directement en MET après adsorption sur une grille recouverte d’un film de Carbone (C), éventuellement renforcé par un film plastique (C/Formvar). Si les objets ont un contraste intrinsèque suffisant (nanoparticules métalliques ou nanoémulsions lipidiques par exemple), les grilles peuvent être observées sans traitement supplémentaire. Dans le cas contraire (virus, liposomes, protéines, acides nucléiques, …), on réalise une coloration négative en incubant les grilles brièvement dans un sel de métal lourd (acétate d’uranyle, acide phosphotungstique, molybdate d’ammonium, …) puis en absorbant l’excès de solution contrastante avec un papier filtre. Dans le MET, les atomes de métal qui sont restés accumulés autour des objets, diffusent fortement les électrons, produisant un halo sombre autour des objets d’intérêt qui apparaissent ainsi en contraste négatif.
Cette technique a l’avantage d’être simple et rapide à mettre en oeuvre. Cependant elle est inadaptée pour les objets trop épais (plus que quelques dizaines de nm dans toutes les dimensions) car la diffusion importante des électrons masquera leur ultrastructure. De plus les grilles doivent être séchées avant d’être observées dans le vide poussé qui règne dans la colonne du MET, ce qui peut générer des artéfacts importants pour les échantillons fragiles comme les liposomes, les nanoparticules lipidiques ou certains virus par exemple. Dans ce cas la cryoMET en film mince est la technique de choix.
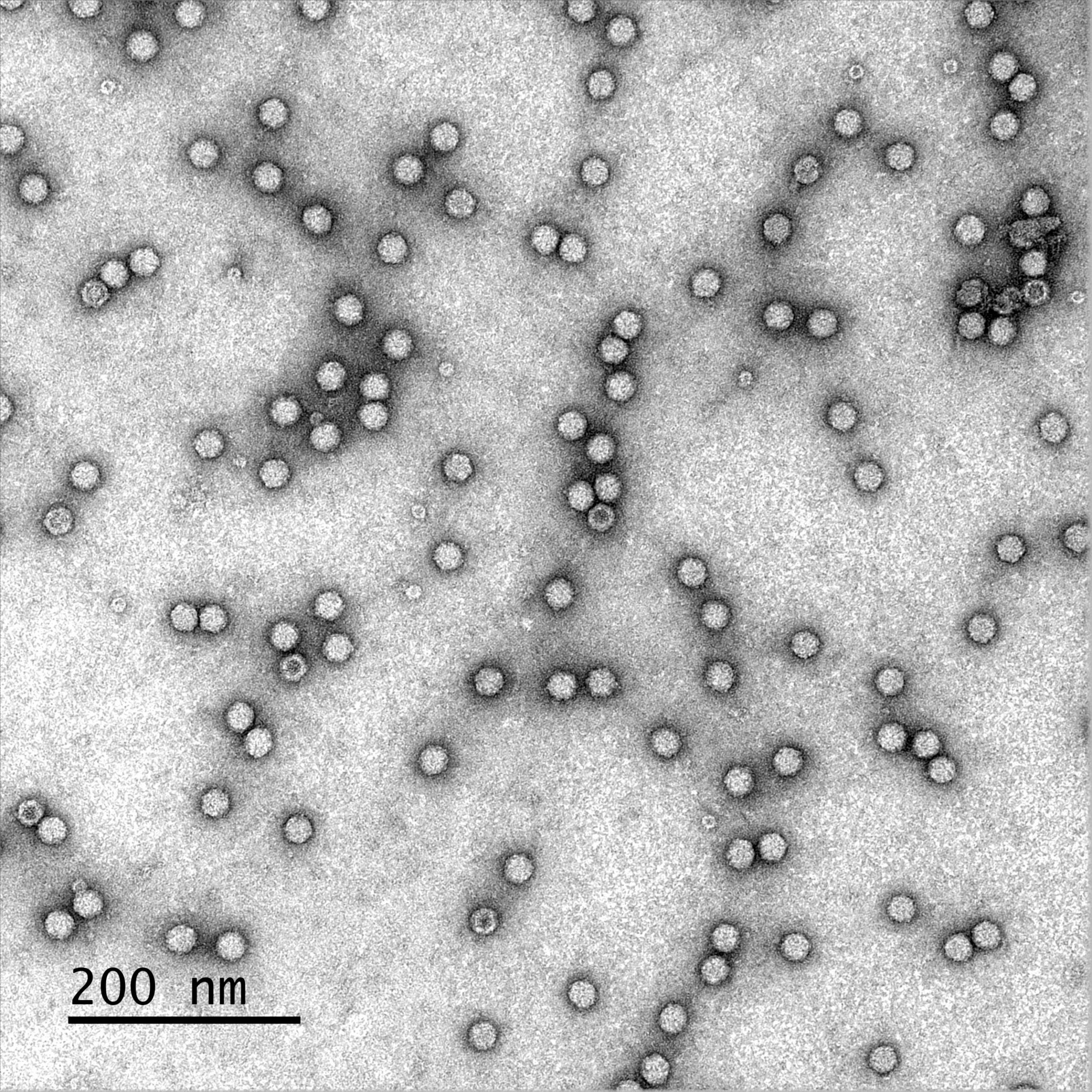
Adeno assosiated virus (Dr Deniz Dalkara, Institut de la Vision)

Cas9 complex with guide RNA (Dr Deniz Dalkara, Institut de la Vision)

Exosomes de lymphocytes (Dr Delphine Garnier, Centre de recherche des Cordeliers)

Bactériophages (Charlotte Izabelle, PICMO)
