Cette approche consiste à congeler les échantillons dans un film mince (de 100 à 200 nm) et à réaliser les observations à une température cryogénique (environ -170°C). Pour cela une goutte (2-5 µL) d’échantillon contenant les objets en solution (protéine) ou en suspension (virus, liposomes, nanoparticules, …) est déposée sur une grille recouverte d’un film plastique perforé. Après absorption de l’excès de liquide (blotting), celui-ci reste dans les perforations sous forme d’un film très mince que l’on congèle en plongeant la grille dans un bain d’éthane liquide refroidi à -180°C. Un appareil dédié (cryoplongeur Leica EM GP2) permet de plonger la grille assez rapidement dans l’éthane pour que la congélation soit quasiment instantanée de manière à éviter la formation de cristaux de glace. Les objets d’intérêt sont ainsi emprisonnés dans une glace amorphe (glace vitreuse), dans un état proche de leur état natif. Après congélation, la grille est transférée dans un porte-objet cryo refroidi à -170°C et observée à cette température.
Cette technique est recommandée pour les objets fragiles dont la structure est significativement altérée par l’approche traditionnelle de coloration négative. Cependant elle est plus longue à mettre en oeuvre, nécessite des conditions d’acquisition particulières (mode faible dose) et requiert des échantillons relativement concentrés.

Nanoparticules CeO2 (Dr Caroline Roques, UTCBS)

Nanoémulsion (Dr Caroline Roques, UTCBS)

Nanocristaux de Fisétine à visée thérapeutique (Pr Yohann CORVIS, UTCBS, Université Paris Cité)
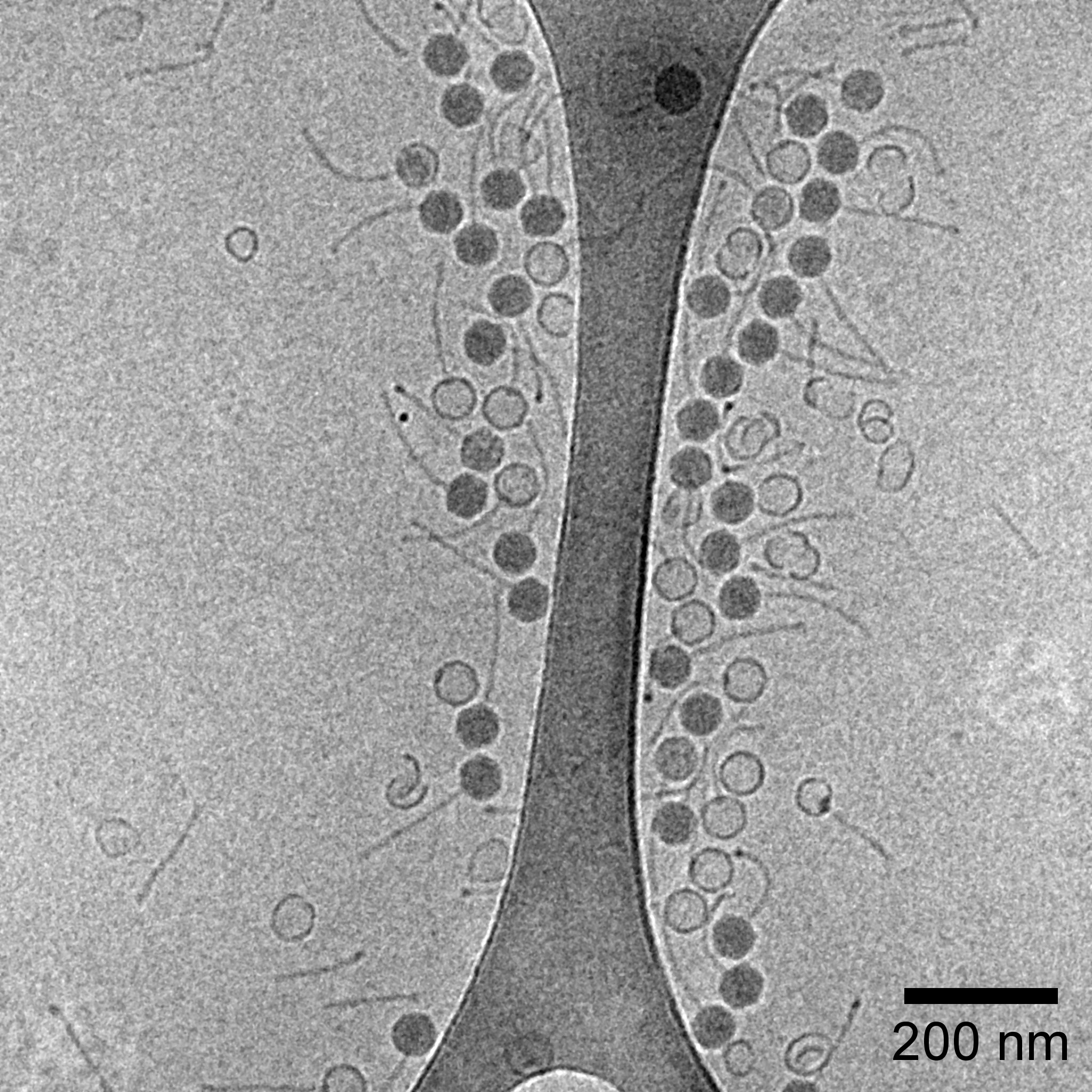
Bactériophage (Charlotte Izabelle, PICMO)
